Les presento un resumen muy interesante y completo del artículo cuya bibliografía menciono, y que nos ayudará a mejorar nuestro trabajo en el Laboratorio de Microbioogía en el área de Tuberculosis, la publicación es:
Introducción
Anales Sis San Navarra vol.30 supl.2 2007
Microbiología de la tuberculosis
Dorronsoro, L. Torroba
Servicio de Microbiología. Hospital de Navarra. Pamplona.Microbiología de la tuberculosis
Dorronsoro, L. Torroba
Introducción
En 1882, Robert Koch describió el agente etiológico de la tuberculosis (TB) y lo denominó Bacteriumtuberculosis. El nombre inicial fue sustituido por el de Mycobacterium tuberculosis en 1896 por Lehmann y Neumann. El término Mycobacterium significa hongo-bacteria, y esta denominación se debe al aspecto de los cultivos, que en su aspecto son similares a los de los hongos.
El descubrimiento de M. tuberculosis causó y sigue causando admiración dadas las características del microorganismo. M. tuberculosis es una bacteria que requiere técnicas especiales de tinción y medios de cultivo distintos a los empleados habitualmente en bacteriología. Además, para poder aislarla, y debido a su lento crecimiento, hay que realizar una decontaminación previa de la mayoría de las muestras, con el fin de destruir la flora acompañante que crece más rápidamente.
Con la llegada de nuevas técnicas de diagnóstico están siendo descritas nuevas especies de Mycobacterium no tuberculosis (MNT), algunas de las cuales están implicadas en la patología humana. Conviene disponer de métodos de identificación rápidos y eficaces pero, debido a la complejidad de las mismas, no está disponible en forma generalizada.
Género Mycobacterium
El orden de los Actinomycetales incluye la familia Mycobacteriaceae, Actinomycetaceae, Streptomycetaceae y Nocardiaceae. La familia Mycobacteriaceae contiene un solo género, el género Mycobacterium, del que en sus orígenes sólo se conocían dos especies: El bacilo de la lepra o Mycobacterium leprae (A. Hansen 1874) y el bacilo tuberculoso o M. tuberculosis.
Hoy en día, dentro del género Mycobacterium se han descrito más de 120 especies de micobacterias diferentes. Se caracterizan por ser bacterias ácido-alcohol resistentes (BAAR) debido al alto contenido en lípidos que tienen en su pared celular. Este hecho impide que penetren los colorantes habituales de anilina, por lo que no se pueden ver en la tinción de Gram, y hace que para poder visualizarlas sean necesarios colorantes especiales (arilmetanos), pero que una vez teñidas no se decoloran con una mezcla de alcohol y ácido.
Las micobacterias son capaces de sobrevivir durante semanas o meses sobre objetos inanimados, siempre que estén protegidas de la luz solar, y son más resistentes a los ácidos, álcalis y desinfectantes que el resto de las bacterias no formadoras de esporas. Resisten la desecación y la congelación, pero la luz ultravioleta y el calor (>65º C durante 30 minutos) las inactiva.
Mycobacterium tuberculosis complex
Engloba a un grupo de micobacterias que presentan >95% de homología en su DNA y que se designa como “complejo M. tuberculosis“ (o MTC). Está compuesto, además de M. tuberculosis, por Mycobacterium bovis, M. bovis BCG (una cepa variante de laboratorio utilizada en vacunación y en instilaciones vesicales en pacientes con neoplasia de vejiga), Mycobacterium africanum (principal causante de la TB en África tropical),Mycobacterium microti (causante de la TB en roedores, llamas y otros mamíferos) y Mycobacterium canetii. Habitualmente se utiliza el termino de M. tuberculosis o bacilo tuberculoso como sinónimo de todas ellas, ya que se identifican, en la mayoría de los laboratorios, mediante la hibridación con una sonda de DNA, común para todo el complejo, y porque el aislamiento de cualquiera de ellas en muestras clínicas establece, por sí mismo, el diagnóstico de TB en el paciente. Sin embargo, entre ellas existen características diferenciales importantes para el manejo de los pacientes (p. e., M. bovis es resistente a pirazinamida) y por su interés epidemiológico.
Mycobacterium no tuberculosis (MNT)
Hoy en día, el 10-30 % de las micobacterias aisladas en laboratorios clínicos corresponden al grupo de las micobacterias no pertenecientes al complejo M. tuberculosis. Este grupo heterogéneo de micobacterias ha recibido históricamente otros nombres como micobacterias atípicas, “Mycobacterium other than tuberculosis” (MOTT), micobacterias ambientales o micobacterias oportunistas. Inicialmente, la nomenclatura de estas especies se realizó atendiendo a su poder patógeno para las distintas especies animales como Mycobacterium simiae o Mycobacterium avium. Posteriormente se fueron aislando otras micobacterias a partir de muestras ambientales (aguas de lagos o ríos, cañerías de los hospitales, suelo, polvo, etc.). Constituyen un grupo muy numeroso, heterogéneo y difícil de sistematizar. Algunas especies son muy ubicuas y poco patógenas; otras son menos ubicuas y su aislamiento tiene un alto valor predictivo de enfermedad; otras no tienen significado clínico conocido y cada vez es más frecuente la descripción de nuevas especies no conocidas previamente. Durante muchos años (primeros 2/3 del siglo XX), apenas se les dio importancia, no obstante, ya en 1954, Timpe y Runyon realizaron un primer intento de clasificación de las MNT aisladas de pacientes, basada en sus características de crecimiento y pigmentación (Tabla 1). Tras el declive progresivo de la TB en los países desarrollados y la irrupción del SIDA, se fue acumulando más experiencia sobre casos clínicos debidos a MNT. En cualquier caso, y a diferencia de MTC, el aislamiento de MNT en muestras de pacientes no es criterio suficiente para establecer el diagnóstico de enfermedad por micobacterias y son poco o nada contagiosas entre las personas.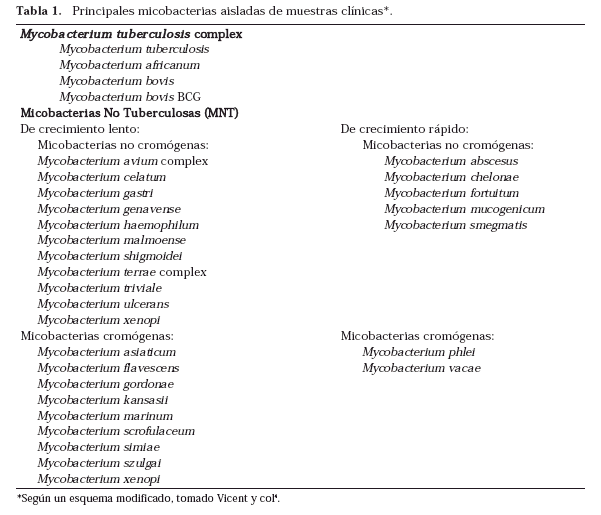

Debido a la frecuencia con que producen enfermedad (micobacteriosis) o bien porque se aíslan con relativa frecuencia en los laboratorios clínicos vamos a reseñar algunas de ellas:
Mycobacterium avium
Se ha aislado del agua, plantas, tierra y otras fuentes ambientales. Tienen baja patogenicidad y conocer el verdadero significado clínico de su aislamiento a partir de muestras respiratorias suele ser muy difícil. Cuando se aíslan repetidamente ante cuadros clínicos similares a TB y no se encuentran otros patógenos puede ser que tengan significación clínica. Entre 1983 (aparición del SIDA) y 1997 (eclosión de la terapia antiretroviral intensiva) fue la causa mas frecuente de infección por micobacterias en los Estados Unidos. Solía afectar a pacientes con recuentos de CD4 inferiores a 50/mm3, dando lugar a un cuadro diseminado (con aislamiento en hemocultivos) que podía afectar a cualquier órgano. Cuando fue descrito este cuadro, la TB en EEUU se hallaba muy controlada y la infección por M. avium fue una de las formas más frecuentes de presentación del SIDA5,6. En otros países como es el caso de España, la incidencia de TB al descubrirse el SIDA era alta y la principal infección por micobacterias en los pacientes coinfectados con el VIH, siempre ha sido la tuberculosis, siendo la infección por M. avium mucho menos frecuente7. La morfología del microorganismo en las tinciones es cocobacilar y sus colonias en los medios de cultivo son muy heterogéneas.
Mycobacterium kansasii
Es una de las especies que se aísla con más frecuencia en casos de micobacteriosis. Produce cuadros clínicos semejantes a la tuberculosis y su aislamiento a partir de muestras respiratorias casi siempre suele tener significado clínico. Pese a ello, antes de atribuirle un significado clínico definitivo se debe procurar su aislamiento repetido, al igual que ocurre con todas las MNT8. Su morfología en la baciloscopia suele ser característica.
Mycobacterium gordonae
Se aísla con frecuencia y no suele tener significación clínica. Hay muy pocos casos, aproximadamente 20, documentados de enfermedad producida por M. gordonae.
En cuanto al resto de micobacterias, hay algunas a las que se atribuyen cuadros clínicos específicos, como las infecciones de piel debidas a M. marinum y M. ulcerans (causante este último de la úlcera de Buruli), y otras que precisan enriquecimientos especiales de los medios de cultivo para poder crecer (Mycobacterium haemophilum y Mycobacterium genavense).
Diagnóstico microbiológico
El diagnóstico microbiológico de la tuberculosis exige la detección, aislamiento e identificación de M. tuberculosis, así como la determinación de su sensibilidad frente a las drogas tuberculostáticas. La detección precoz del individuo bacilífero es uno de los pilares básicos de una buena organización en la lucha contra la tuberculosis.
La sensibilidad y especificidad de los distintos métodos de detección es variable y depende mucho de la experiencia e idiosincrasia de cada laboratorio en particular y de cómo los adapte a su rutina de trabajo. En general, el examen microscópico directo de las muestras clínicas, mediante técnicas específicas de tinción (baciloscopia), es la técnica menos sensible pero la más rápida. Los cultivos son las más sensibles y más lentas, mientras que las técnicas moleculares basadas en amplificaciones genómicas tienen una sensibilidad menor que los cultivos pero son más rápidas.
La sensibilidad de la baciloscopia aumenta cuando las muestras se concentran. El cultivo aumenta la sensibilidad de la baciloscopia en un 30-60%, dependiendo del laboratorio, del tipo de muestra, y de los medios utilizados. La utilización de medios líquidos ha mejorado notablemente los resultados del cultivo por lo que en la actualidad, resultan imprescindibles. En el laboratorio del Hospital de Navarra se empezó en 1996, a utilizar un medio líquido (BACTEC 460TB, Becton Dickinson), junto con el medio sólido clásico de Löwenstein-Jensen (L-J). Posteriormente, se observó que el 18,6% de los aislamientos de M. tuberculosis se realizaron exclusivamente en el medio líquido y el tiempo medio de diagnóstico se acortó a 14,2 días, frente a 22,7 días que tardaban en aparecer las colonias en L-J.
Se han desarrollado una variedad de pruebas inmunológicas, que ponen de manifiesto la respuesta específica del huésped frente al agente infeccioso. La prueba de la tuberculina fue la primera empleada y ha sido la más utilizada, aunque no permite diferenciar la infección de la enfermedad. Se han descrito una variedad de pruebas “in vitro” (QuantiFERON-TB Gold and T-SPOT.TB) que miden la producción de interferon-gamma frente a antígenos específicos de micobacterias para ver la respuesta inmune y de las que se ha tratado en el anterior capítulo de este tratado9.
Organización de los laboratorios
La American Thoracic Society recomienda que el diagnóstico microbiológico de la tuberculosis se lleve a cabo, únicamente, en laboratorios con las adecuadas medidas de seguridad y cuyo volumen de trabajo y competencia en el área de las micobacterias esté asegurada10.
En 1993, ante el resurgir de la tuberculosis en Estados Unidos, los “Centers for Disease Control and Prevention” (CDC) de Atlanta, dieron las siguientes recomendaciones para los laboratorios de micobacterias:
Proporcionar a los laboratorios los medios para que puedan informar de los resultados de los exámenes directos en 24 horas.
Exigir que los laboratorios utilicen técnicas de tinción fluorescentes, más sensibles que las clásicas de Ziehl-Neelsen.
Utilizar medios líquidos en el cultivo primario, conjuntamente con el clásico de L-J.
Utilizar medios rápidos de identificación como sondas.
Realizar los estudios de sensibilidad en medio BACTEC o similares, que proporcionen resultados fiables y rápidos.
La finalidad de estas recomendaciones es proporcionar al clínico información rápida que le sirva para la toma de decisiones, de modo que: los exámenes directos no se demoren más de 24 h, el aislamiento e identificación deM. tuberculosis pueda realizarse en 10-14 días y los resultados del estudio de sensibilidad puedan estar disponibles en 15-30 días11. La consecución de estos objetivos es hoy factible en muchos laboratorios.
Recogida y transporte de muestras
Un concepto clásico en el diagnóstico de la tuberculosis es que la eliminación de bacilos, en muchos casos puede ser intermitente. Este concepto lo avala el hecho de que en ocasiones, entre varias muestras procesadas, sólamente una resulta positiva. La mejor muestra es la primera expectoración de la mañana. Las muestras una vez obtenidas, bien cerrado el frasco y bien identificadas, se transportan al laboratorio lo mas rápidamente posible. Si va a transcurrir más de una hora entre la expectoración y la recepción en el laboratorio deberá permanecer en frío (5-8ºC) y no a temperatura ambiente. Se desaconseja la práctica de recomendar al paciente que guarde 3 esputos y los lleve a la vez al laboratorio ya que es muy probable que se contaminen.
Técnicas de tinción o baciloscopias
Tienen por objeto, poder visualizar en el microscopio la presencia o no de BAAR en las muestras. Actualmente siguen constituyendo la forma más rápida y económica para diagnosticar la TB. No obstante, dado que su sensibilidad (40-70% en muestras respiratorias) y su especificidad no son absolutas, es necesario realizar siempre cultivos para un diagnóstico de certeza. Existen diversas técnicas para las baciloscopias, no obstante, las dos más utilizadas son:
•La tinción de Ziehl-Neelsen. Utiliza fucsina y fenol junto con el calentamiento de las preparaciones. Las micobacterias se tiñen de rojo, colorante que perdura pese a la posterior decoloración con una mezcla de alcohol-clorhídrico, sobre un fondo azul o verde, según se utilice como colorante de contraste el azul de metileno o el verde malaquita. Exige la observación con el objetivo de inmersión (1.000 aumentos), por lo que, debido a que en muchas preparaciones la presencia de bacilos puede ser escasa, es necesario un mínimo de 10 minutos de observación antes de valorar el examen como negativo.
•Las tinciones con fluorocromos. Emplean como primer colorante la auramina-rodamina. Se tiñen en frío y, como en el caso anterior, tampoco se decolora con la mezcla de alcohol-clorhídrico. Al observarlos en un microscopio de fluorescencia, las micobacterias emiten una luz fluorescente. Esta luz emitida puede ser detectada rápidamente. Las preparaciones se observan con un objetivo de menor aumento, con lo que la superficie visualizada es mayor, lo cual hace que la tinción resulte más sensible y requiera menos tiempo de observación (1-2 minutos). Los inconvenientes de esta técnica son la dificultad del enfoque, que requiere un microscopio de fluorescencia, que algunas MNT de crecimiento rápido puede que no se tiñan, que puede a la larga dañar la vista del observador y, sobre todo, que es necesario personal con suficiente experiencia para visualizarlas. La decisión de utilizar una u otra en cada laboratorio está en función del número de baciloscopias que se realizan, la dotación de personal (su número y su experiencia) y del material disponible. En una jornada laboral un solo observador es prácticamente imposible que pueda ver más de 15-20 tinciones de Ziehl con garantías, mientras que podría ver 50-60 tinciones fluorescentes.
Cuantificación de las baciloscopias
El número de bacilos ácido-alcohol resistentes presentes en una muestra es un índice de la severidad de las lesiones y del grado de infectividad, por lo que la cuantificación de las muestras positivas es una práctica habitual pero hay que tener en cuenta si la tinción se ha realizado de la muestra directa o tras el proceso de HDC. En muchos laboratorios, como en el nuestro, no se realiza rutinariamente una baciloscopia a la muestra directamente sino que se hace siempre tras el proceso de decontaminación ya que se consigue mayor sensibilidad. Cuando se utiliza un fluorocromo3 y si únicamente se observan hasta 9 bacilos en toda la preparación, se informa como Dudosa. Entre 1-9 bacilos en 10 campos, se informa: Positiva 1+. Entre 1-9 bacilos por campo, se informa: Positiva 2+. Entre 10-90 bacilos por campo, se informa: Positiva 3+; y si se observan mas de 90 bacilos por campo, se informa: Positiva 4+.
Morfología de los BAAR
Habitualmente la morfología de los BAAR en las tinciones no permite diferenciar si se trata de una micobacteria u otra. No obstante un observador experimentado puede sospechar que no se trata de MTC cuando no aprecia su forma alargada y su dishomogeneidad en la coloración. Hay que tener en cuenta que la morfología del bacilo se altera durante el tratamiento tuberculostático. M. kansasii puede observarse como muy largo y con morfología acebrada lo que, aunque no definitivo, es muy característico. M avium se ve como bacilos muy cortos y con tinción uniforme. Mycobacterium fortuitum y Mycobacterium chelonae pueden ser muy polimorfos.
Causas de falsos positivos
Existen una serie de circunstancias técnicas que pueden dar lugar, en personal no experimentado, a errores al informar como BAAR acúmulos de pigmento debidos: a la presencia de restos de comida, aceites, cera o fibras en la muestra, a la reutilización de portas con fisuras en las que se acantona el colorante o a la no filtración de los reactivos. Otras veces se ven verdaderos BAAR pero puede tratarse de MNT en vez de MTC y ser saprofitos o colonizantes del paciente. También se dan casos de falsos positivos en los que los BAAR visualizados no pertenecen al paciente; así, si las cañerías del hospital están colonizadas con MNT y utilizamos esta agua para preparar la solución decontaminante luego podremos visualizarlas en la baciloscopia, o bien cuando transferimos BAAR de un porta a otro con el aceite contaminado utilizado con el objetivo de inmersión, en la microscopía óptica.
Causas de falsos negativos
Pueden encontrarse falsos negativos por realizar un frotis demasiado grueso o demasiado fino, por desprendimiento del frotis si calentamos excesivamente el porta. La falta de tiempo, la impaciencia o el cansancio del observador es la más importante. En el caso de tinción con fluorocromos la exposición excesiva a la luz UV pude hacer perder la capacidad de emitir fluorescencia. Hay que tener en cuenta que al hacer una extensión del material en el porta para la realización de la baciloscopia se utilizan 0,01 ml. Cuando en 1 ml de esputo hay un millón de BAAR la baciloscopia siempre suele ser positiva mientras que si hay 10.000 BAAR sólo es positiva en el 60%. La sensibilidad claramente disminuye cuando el nº de BAAR/ml de esputo es menor.
Persistencia de baciloscopias positivas en pacientes recibiendo tratamiento adecuado
A los 30 días de tratamiento el nº de BAAR visualizados en la tinción debe ser claramente inferior al de la baciloscopia inicial. Hasta el 50% permanecen con baciloscopias positivas al final del segundo mes y menos del 20% son positivos al final del tercer mes. Esta persistencia de baciloscopias positivas no debe hacer pensar en fracaso del tratamiento siempre que los cultivos sean negativos. Estos deben ser negativos a partir de los 30 días de tratamiento.
Técnicas de cultivo
Los cultivos siguen siendo los métodos más sensibles para la detección de MTC en pacientes que no están recibiendo tuberculostáticos. Pueden detectar entre 10 y 100 bacilos/ml de esputo. A pesar del gran desarrollo y revolución que han supuesto, desde 1990, las técnicas moleculares, sobre todo las basadas en amplificación de ácidos nucleicos (AAN), ninguna de ellas, a fecha actual, ha conseguido en estudios clínicos ser tan sensible como los cultivos. Sin embargo, precisaremos de medios de cultivo específicos ya que con la inoculación directa de la muestra en los medios de cultivo habituales no crecen las micobacterias. El microbiólogo por tanto debe ser informado de si a una muestra respiratoria se le desea buscar una micobacteria o no.
La mayoría de las muestras respiratorias (excepto el líquido pleural obtenido por toracocentesis) contienen otros microorganismos que crecen rápidamente y que es preciso eliminar para que puedan desarrollarse las micobacterias. Para ello se realizan unos procedimientos de decontaminación de la muestra que a su vez la homogeneizan y la concentran (DHC). Estos procedimientos empleados para destruir las bacterias contaminantes deben preservar a las micobacterias, sin embargo, no es posible inactivar los contaminantes sin dañar a las micobacterias. Se acepta que el procedimiento es adecuado si se contaminan (y por tanto no son útiles para establecer el diagnóstico) un 5% de los cultivos realizados. Si el porcentaje de cultivos contaminados es inferior se asume que la decontaminación es excesiva y puede hacer que, si la cantidad de micobacterias presentes en la muestra es pequeña, éstas no sean viables y no crezcan en los cultivos.
Todo el procesamiento, debe llevarse a cabo en cabinas de seguridad biológica y por personal bien entrenado. Deben extremarse las medidas y los controles para evitar tanto la contaminación del personal, como la de otras muestras que se procesan al mismo tiempo.
Existen diversos métodos descritos para decontaminar las muestras. Los más utilizados han sido los del laurilsulfato sódico (descrito por Tacquet y Tison) y el de la N-acetil-cisteína-hidróxido sódico (NALC-NaOH). Es muy buena opción cuando se utilizan medios en base de huevo ya que la lecitina inactiva la acción antibacteriana. La incorporación rutinaria en los últimos 10 años de los medios líquidos ha hecho que la mayor parte de los laboratorios utilicemos el NALC-NaOH siguiendo las recomendaciones de los proveedores y de los CDC.
Estos métodos de DHC son muy laboriosos y tediosos para los trabajadores durando varias horas y en ellos hay una serie de variables que pueden incidir en que luego podamos recuperar o no el MTC. La concentración del decontaminante, el tiempo que está en contacto con la muestra, las revoluciones y la temperatura de la centrífuga son las más importantes.
Una vez que las muestras se han decontaminado y concentrado, se procede a la realización de las extensiones para tinción y a la inoculación de los medios de cultivo.
La incubación de los medios de cultivo se realiza a 35-37ºC que es la temperatura óptima para el desarrollo de la mayoría de las micobacterias, con excepción de las muestras de piel que deben incubarse además a 28ºC ya que muchas micobacterias que producen infecciones de la piel y tejido subcutáneo se aíslan a esta temperatura. Los cultivos se mantienen un mínimo de 7 semanas antes de descartarlos como negativos.
Los medios de cultivo pueden ser líquidos o sólidos. Éstos a su vez se diferencian en que la base sea agar (las diferentes variantes del agar Middlebrook son las más utilizadas) o de huevo (el medio L-J y el medio Coletsos son los más utilizados).
La detección del crecimiento depende del tipo de medios empleados. Con los medios sólidos en base de huevo la detección se realiza mediante la observación macroscópica 1 vez por semana. Si utilizamos medios en base de agar habrá que visualizarlos con el microscopio (100 aumentos) 2-3 veces por semana. Los medios en base de agar cada vez son menos utilizados de forma rutinaria ya que consumen mucho tiempo de personal experimentado para poder leerlos y a que la fundamental ventaja que antaño tenían, que era la detección más precoz del crecimiento, es menor desde la incorporación de los medios líquidos.
Los medios líquidos son más sensibles que los sólidos y además detectan el crecimiento más precozmente. Antiguamente sólo se utilizaban en muestras muy concretas como líquidos cefalorraquídeos. A principios de la década de los 80 salió al mercado un sistema denominado BACTEC 460, hoy en día comercializado por Becton Dickinson (BD), que consiste en unos frascos con medio líquido Middlebrook 7H9 modificado (denominado Middlebrook 7H12) en que el ácido palmítico del medio está marcado con un isótopo del carbono. Los viales son leídos 2-3 veces por semana las dos primeras semanas y 1 vez por semana las cinco restantes en un aparato que pincha el frasco y detecta si hay o no crecimiento bacteriano en función de la radiactividad medida. Constituye el patrón de referencia con el que se comparan todos los medios antes de ser aprobados para su uso diagnóstico. Sólo algunos hospitales dotados de infraestructura para trabajar con material radiactivo lo introdujeron en su rutina de trabajo.
A partir de 1995 empiezan a salir al mercado medios líquidos que obvian el problema de la radiactividad y del tener que pinchar el frasco (con la teórica posibilidad de contaminar un frasco con bacterias del frasco anterior). Estos medios se introducen en unos aparatos que incuban los frascos y a su vez realizan una monitorización continua de la actividad metabólica que hay en su interior para ver si hay crecimiento o no. Los más utilizados son el MGIT (Mycobacterial Growth Indicator Tube, BD), el ESP Culture System II (Trek Diagnostic Systems) y el MB/BacT ALERT 3D (BioMerieux). MGIT utiliza un sensor de fluorescencia, ESP de presión y MB/BacT de colorimetría para detectar el crecimiento. Estos sistemas se han introducido en la mayor parte de los laboratorios y han constituido un gran avance.
Técnicas de identificación
Una vez que se ha detectado crecimiento en alguno de los medios, se realiza la tinción de Ziehl-Neelsen para ver si lo que ha crecido son BAAR o no (Fig. 3). Caso de ser BAAR, su morfología nos puede orientar, en algunas ocasiones, hacia una especie u otra como en el caso de M. avium o de M. kansasii. Además la visualización de BAAR formando cordones (en medios líquidos) es muy característica del crecimiento de M. tuberculosis, aunque no patognomónica (Fig. 4).
Lo prioritario para el manejo de los pacientes es saber si se trata de MTC o de MNT. Para ello, hoy en día, la mayoría de los laboratorios realizan la identificación de MTC mediante sondas genéticas debido a su rapidez, precisión y simplicidad.
Tradicionalmente la identificación se realizaba en base a una serie de características fenotípicas. La velocidad de crecimiento en los cultivos y la temperatura óptima para ello, la morfología de la colonia, su pigmentación y su fotorreactividad orientaban preliminarmente hacia unas micobacterias u otras y posteriormente se realizaban pruebas bioquímicas a partir de la cepa crecida. Se considera que una micobacteria es de crecimiento lento cuando al hacer un subcultivo de una cepa, en medios de cultivo como el L-J, tardan más de 5-7 días en apreciarse las colonias macroscópicamente. Es cromógena cuando la colonia presenta pigmentación (Fig. 5), no cromógena cuando no la presenta y fotocromógena cuando pigmenta tras exposición a la luz. M. tuberculosis es una micobacteria no cromógena (Fig. 6) y de crecimiento lento. Sin embargo, cuando la baciloscopia es muy positiva, crece en los cultivos en medios líquidos en menos de una semana. Algunas de las pruebas bioquímicas utilizadas en la identificación de las micobacterias son el test de acumulación de niacina, la reducción de los nitratos, la hidrólisis del Tween, la catalasa, la captación de hierro, la pirazinamidasa, la detección de actividad ureasa, arylsulfatasa, etc.
Estos métodos clásicos, basados en pruebas bioquímicas, son muy lentos, laboriosos y peligrosos para el trabajador (además del riesgo de contagio, ya que se requiere trabajar con inóculos fuertes de micobacterias vivas, hay pruebas bioquímicas como la de la niacina, que suele ser positiva en M. tuberculosis en la que se formaban compuestos de cianuro). Tiene la limitación de que no permite la diferenciación entre las diferentes variantes del complejo MTC. La diferenciación entre ellas se hará mediante pruebas bioquímicas clásicas como la producción de nitritos y la sensibilidad a pirazinamida o mediante estudios moleculares. Los métodos clásicos de identificación están siendo sustituidos por los cromatográficos o genético-moleculares.
Identificación cromatográfica mediante análisis de los ácidos micólicos
Los ácidos micólicos son ácidos grasos de alto peso molecular que forman parte de la pared celular de las micobacterias y otros géneros relacionados (Nocardia, Corynebacterium, Rhodococcus, Tsukamurella, etc.) El análisis de los ésteres de estos ácidos con diferentes técnicas cromatográficas permite realizar una identificación rápida, precisa y reproducible. La cromatografía líquida de alta eficiencia (HPLC) ha sido la que más se ha desarrollado y estandarizado. No obstante se requiere partir de abundante masa de bacterias para poder realizarlas lo cual implica que se necesita más tiempo hasta conseguir que el cultivo alcance la suficiente masa.
Identificación mediante estudios genético-moleculares
El genoma completo de una cepa de MTC se ha secuenciado y contiene 4,4 millones de pares de bases, 4.000 genes que codifican proteínas y 50 que codifican RNA4. Las micobacterias contienen regiones bien conservadas de su DNA específicas de género y regiones hipervariables específicas de especie. Estas últimas son las que se utilizan como dianas, siendo las mejor estudiadas: el gen hsp65, que codifica la proteína de 65 KDa (heat shock), regiones genómicas de la subunidad ribosómica 16S, la región intergénica 16S-23S y los elementos de inserción. El grupo de técnicas que mayor interés y desarrollo tienen hoy en día se basan en la AAN de algunas de las secuencias citadas. Algunas de las más utilizadas son:
PCR-RFLP (PRA)
Consiste en realizar una PCR (reacción en cadena de la polimerasa), que es una de las técnicas de AAN más utilizada, del gen hsp65 seguida de un posterior análisis del polimorfismo de la longitud de los fragmentos de restricción. Consigue una identificación rápida (en una jornada laboral), precisa y económica de múltiples cepas. Tiene muchísima capacidad discriminatoria, siendo capaz de diferenciar unas 36 especies diferentes y las subespecies de los diferentes complejos micobacterianos, pero no discrimina las diferentes variantes del MTC. No necesita mucha masa de micobacterias y el equipamiento necesario no es excesivamente caro. Aunque bastante estandarizado tiene el inconveniente de que no es un método demasiado sencillo de realizar y que no está comercializado ni aprobado por la FDA.
Hibridación en fase sólida
Se basa en la disponibilidad de sondas cortas de DNA específicas de especie, presentadas en formatos convencionales (placas con micropocillos, tiras de nitrocelulosa, etc.) o novedosos (chips o arrays de DNA). Se aplica el producto amplificado frente a diversas sondas en una sola prueba. Existen 2 productos comerciales con tiras de nitrocelulosa (INNO-LIPA y GenoType). Ambos se basan en la amplificación de una secuencia genética concreta (espacio intergénico 16S-23S y el 23S rDNA respectivamente) y su posterior hibridación. Los resultados se obtienen en 5-6 horas, son de fácil lectura e interpretación y además permiten detectar posibles coinfecciones. La sensibilidad y especificidad de ambas es muy buena.
Siempre hay que intentar la identificación de toda micobacteria, aislada de muestras clínicas, a nivel de especie aunque no se sepa su valor como patógeno.
Pruebas directas de detección de ácidos nucleicos de MTC en muestras clínicas
Tienen por objeto detectar e identificar sobre la muestra (y no sobre los cultivos) la presencia de micobacterias del complejo tuberculosis. En teoría serían capaces de detectar la presencia de una sola micobacteria en la muestra, pero en la práctica ningún estudio ha demostrado que sean tan sensibles como los medios de cultivo líquido. Sí que son más sensibles que las baciloscopias y más rápidos que los cultivos. Habitualmente no se realizan sobre la muestra directa sino sobre el producto obtenido tras el proceso de DHC. En 24-48 horas desde la entrada de la muestra al laboratorio se puede detectar si hay o no MTC en la muestra. Existen varios en el mercado.
Estudios de sensibilidad
Su finalidad es poder predecir, si la cepa aislada responderá al tratamiento tuberculostático convencional o bien si presenta algún mecanismo de resistencia que indican que una determinada droga no va a ser efectiva.
El incremento de cepas resistentes registrado a partir de los años 90, hace que los estudios de sensibilidad sean recomendables hoy en día frente a todas las cepas de M. tuberculosis que se aíslan inicialmente a cualquier paciente.
El problema de la resistencia en la tuberculosis está ligada al hecho de la elevada concentración bacteriana presente en las lesiones. En la tuberculosis pulmonar, la mayor concentración bacteriana se da en las lesiones cavitadas que pueden contener hasta 107 ó 109 organismos, mientras que la concentración presente en los focos caseosos, no suele exceder los 102 ó 104. Desde 1949, era un hecho conocido, que la aparición de resistencias, se daba con mucha más frecuencia en el tratamiento de lesiones cavitadas.
David27 en 1970, demostró la probabilidad de distribución de mutantes resistentes, mediante un test de fluctuación, con el que puso en evidencia, que M. tuberculosis adquiría espontáneamente una mutación que le hacía resistente a isoniacida, estreptomicina, etambutol y rifampicina con una frecuencia media de 3x10-8, 3x10-8, 1x10-7, y 2x10-10 respectivamente. De este modo, la probabilidad teórica de adquirir una mutación que confiera resistencia a dos drogas es menor a 10-15. De ahí que la base del tratamiento de la tuberculosis sea el empleo de varias drogas efectivas simultáneamente.
Los criterios para definir la resistencia a una droga en M. tuberculosis se han tomado sobre una base empírica, teniendo en cuenta que a partir de una cierta proporción en el número de mutantes resistentes, la droga no va a ser efectiva. En base a estudios clínicos y bacteriológicos, se acepta como proporción crítica la del 1%. Si se produce un crecimiento por encima de esta proporción, se valora la cepa como resistente.
Para estudiar la sensibilidad de las micobacterias, se emplea generalmente el método de las proporciones, es decir se compara el número de colonias que crecen en un medio con droga y el número de colonias que crecen en el mismo medio libre de droga. Si el número de colonias en el primero no llega al 1% del segundo, la droga se considera efectiva.
La realización del antibiograma en medios líquidos cada vez es más frecuente por su relativa sencillez, reproducibilidad y rapidez, ya que los resultados pueden obtenerse en 5-10 días, frente a 3 semanas que requieren los medios sólidos. En el método radiométrico BACTEC, que equivale a una versión modificada del de las proporciones, la resistencia se determina comparando el crecimiento que se detecta en un vial control sin droga y en otro igual que contiene la droga que se quiere testar. El vial que contiene droga se inocula con una concentración de bacterias 100 veces superior a la del control sin droga. Los viales se leen diariamente, registrándose su índice de crecimiento. Se determina la diferencia entre los índices que se registran en días consecutivos. Cuando el índice de crecimiento en el vial control alcanza un valor determinado, se interpretan los resultados del siguiente modo: si la diferencia entre los índices de crecimiento, es menor en el vial que contiene droga que en el control, la población es sensible; si mayor, es resistente. Se debe hacer constar cuál es la concentración o concentraciones a las que se ha testado el fármaco. Es posible que cepas resistentes a INH a concentraciones bajas y sensibles a concentraciones altas respondan a INH y no se deba suspender su prescripción. Los estudios se realizan frente a los 4 tuberculostáticos principales: isoniacida, estreptomicina, rifampicina y etambutol. La pirazinamida solamente es activa en medio ácido por lo que es preciso bajar el pH del medio, con lo que muchas veces, queda comprometido el crecimiento bacteriano. El sistema BACTEC ha resuelto este problema utilizando una modificación del medio de cultivo para el estudio de esta droga.
Aunque con menos experiencia que con el BACTEC radiométrico también se han desarrollado y adaptado los antibiogramas a otros medios líquidos como el ESP, el MGIT y el MB/BacT ALERT 3D.
Los estudios de sensibilidad frente a otras drogas resultan problemáticos y no están bien estandarizados31. La utilidad de los antibiogramas de MNT para guiar el tratamiento de las micobacteriosis no está clara. Puede ser útil testar M. avium frente a macrólidos y M. kansasii frente a rifampicina
Cuando el paciente, por datos epidemiológicos conocidos, es probable que albergue una cepa de MTC resistente y la baciloscopia sea claramente positiva, puede plantearse realizar el antibiograma directamente de la muestra. Posteriormente se debe confirmar el antibiograma con la técnica estandarizada a partir del cultivo.
Se han descrito diversos genes cuya mutación se asocia con la resistencia a drogas. Así, la resistencia a rifampicina en más del 96% de los casos se debe a una mutación en el gen rpo. En cuanto a la isoniacida, se han descrito diversos genes katG, inhA, ahpC, kasA, que en su conjunto son responsables de la resistencia a esta droga aproximadamente en un 90% de los casos; la resistencia a etambutol en un 47-65% de los casos, se debe a una mutación en el gen embB y la resistencia a estreptomicina en un 70% se debe a la mutación del genrpsL. Se han desarrollado múltiples métodos moleculares para detectar la posible existencia de estos mecanismos de resistencia con el objeto de no tener que esperar los 5-10 días que puede tardar el antibiograma a partir de que la cepa este aislada, pero todavía no son lo suficientemente simples como para incorporarlos a la rutina diagnóstica.
En el Hospital de Navarra, el promedio del porcentaje de cepas resistentes a isoniacida en 5 años (1998-2002) es del 7%, que es un índice relativamente alto, sin embargo, la incidencia de cepas multirresistentes es decir, resistentes al menos a isoniacida mas rifampicina, en ese mismo período de tiempo, no llegó al 2%.
Consideraciones finales
1. La baciloscopia sigue siendo el método más rápido y barato para diagnosticar la TB en nuestro medio.
2. El diagnóstico de certeza se establece con el aislamiento en cultivo e identificación de M. tuberculosis a partir de muestras clínicas.
3. La utilización sistemática de medios de cultivo líquidos ha aumentado su sensibilidad y rapidez. También ha hecho que se aíslen más micobacterias no tuberculosas cuya significación clínica es, en muchas ocasiones, difícil de establecer.
4. Los estudios de sensibilidad deben realizarse a todo primer aislamiento de M tuberculosis en centros acreditados y con suficiente experiencia.
5. El gran desarrollo de la tecnología molecular de ácidos nucleicos ha permitido en muchos laboratorios que la detección e identificación de M tuberculosis y otras micobacterias sea más rápida y precisa.
6. Las técnicas moleculares están permitiendo conocer mejor los factores de virulencia del microorganismo, sus mecanismos de resistencia y aspectos epidemiológicos de las micobacteriosis, que redundarán en un mejor manejo de la enfermedad y de los pacientes.
Extracto del artículo:
Tuberculosis
Luis Torroba Álvarez
Laboratorio de Microbiología
Hospital Virgen del Camino
C/ Irunlarrea, 4
31008 Pamplona
Luis Torroba Álvarez
Laboratorio de Microbiología
Hospital Virgen del Camino
C/ Irunlarrea, 4
31008 Pamplona
Pabellón de Docencia, Recinto Hospital de Navarra, C/ Irunlarrea, 3, 31008 - Pamplona, Tel.: 848 422 653, Fax: 948 422 009
Anales Sis San Navarra vol.30 supl.2 2007
Microbiología de la tuberculosisDorronsoro, L. Torroba
Microbiología de la tuberculosisDorronsoro, L. Torroba
Servicio de Microbiología. Hospital de Navarra. Pamplona.